

Problème de quantité de matière dans un tableau d'avancement ....
Chimie > sujets expliqués - 28/10/2009 - Question simple
Conversation avec le cyberprof |
||||||
| Lors de la vinification du vin, des ions sulfates sont ajoutés sous forme de sulfate de calcium, d'ammonium ou de cuivre; ils sont notées globalement SO4 2-(aq). La quantité de sulfate dans un vin est règlementée par l'Etat, elle est soumise a un maximum à ne pas dépasser: 1,1g d'ion sulfate SO4 2- par litre de vin. Les vins sont donc testés avant commercialisation. Parmi les méthodes officiels d'analyse des vins et des moûts ( arrêté du 24juin 1963) , on trouve une méthode de mesure concernant les ions sulfates: " les ions sulfates sont précipités par le chlorure de baryum ajouté au vin préalablement débarrassé du dioxyde de soufre par ébullition à l'abri de l'air. Le sulfate de baryum formé est pesé". L'équation bilan de la réaction correspondante peut s'écrire: Ba2+ (aq) + SO4 2- = BaSO4 (s) On introduit 100 ml de vin ( acidifié et dégazé) dans un bêcher puis on ajoute 20 ml de solution de chlorure de baryum de concentration 0,20 mol.L-1 . On agite, on filtre et on sèche le précipiter de sulfate de baryum dans un four à 400°C. On le pèse et on trouve m=0,440g. a. Calculer la valeur de la quantité de matière n1 de chlorure introduite a l'état initial b. Calculer la valeur de la quantité de matière n3 de sulfate de baryum solide solide isolé à l'état final . c. Établir le tableau d'évolution de la transformation en notant n2 la quantité de matière initiale de SO4 2- (aq). d. Donner la relation entre n2 et n3. est-il légitime d'admettre que le chlorure de baryum a été introduit en exès? e. Quelle était la quantité de matière d'ions sulfate dans l'échantillon de 100ml de vin traité? dans 1,0L de vin ? f. Déterminer la concentration massique en sulfate du vin et dire si ce vin respecte la règlementation. J'ai trouver les 2 premières questions, mais dans mon tableau d'avancement je doi aussi donne la quantité de matière de SO4 ? comment je fait pour la trouver, le m donner dans l'énoncer est-il la masse de SO4 où celle de BaSO4 ? |
||||||
 |
déjà, que trouves-tu pour n1 et n3 ? | |||||
alors pour n1 j'ai trouvée 4.10 | ||||||
 |
il doit y avoir une erreur, ayant introduit n1 mole de Ba2+, tu ne devrais pas pouvoir produire plus de n1 mole de BaSO4. Si ? | |||||
Ok j'ai compris la tableau d'avancement et je me disais aussi que l'on pouvais trouver n2 en faisant n3-n1 . | ||||||
 |
Si Wikipedia ne se moque pas de moi, la masse molaire du Baryum est 137 g.mol-1, donc je vois mal le sulftate de baryum à 104 g.mol-1. | |||||
je trouve 1,8. | ||||||
 |
0.44 / 233 = 0.00188841202 | |||||
Dans mon tableau d'avancement est-ce que la plus grande valeur doit être celle de n3? | ||||||
 |
Ben, réfléchis deux secondes. | |||||
Matières disponibles
sciences
. chimie
. mathématiques
. physique
. biologie
langues vivantes
. anglais
. espagnol
. allemand
. italien
lettres
. français
. lettres
sciences humaines
. philosophie
. histoire
. SES-éco
. droit
. culture générale
. géographie
Niveaux scolaires
. Collège
. Lycée
. Fac (DEUG)
. Classes préparatoires - CPGE
. BTS
. DUT
. Fac (> DEUG)
. Ecoles (> BAC+2)
parents d'élèves : nos conseils
Qu'est-ce que Cyberprofs.com ?
Derniers devoirs traités
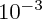
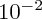 /104
/104